近期,中国科学院合肥物质院强磁场中心、安徽省高场磁共振成像重点实验室田长麟团队与南京大学黄小强团队、梁勇团队合作,在光酶催化研究领域取得重要进展。针对合作团队开发的焦磷酸硫胺素(ThDP)依赖酶和光催化协同的双催化新体系,田长麟团队依托稳态强磁场实验装置电子顺磁共振(Electron Paramagnetic Resonance, EPR)鉴定了催化反应中的自由基中间体及电子转移机制,研究成果2023年12月18日在线发表于《自然》(Nature)杂志。
生物制造是变革工业可持续发展最有希望的绿色技术之一。但是生物制造的“芯片”——酶,面临催化机制理解相对有限、我国在核心酶方面的自主率低等问题,成为限制生物制造及合成生物学发展的“卡脖子”问题。
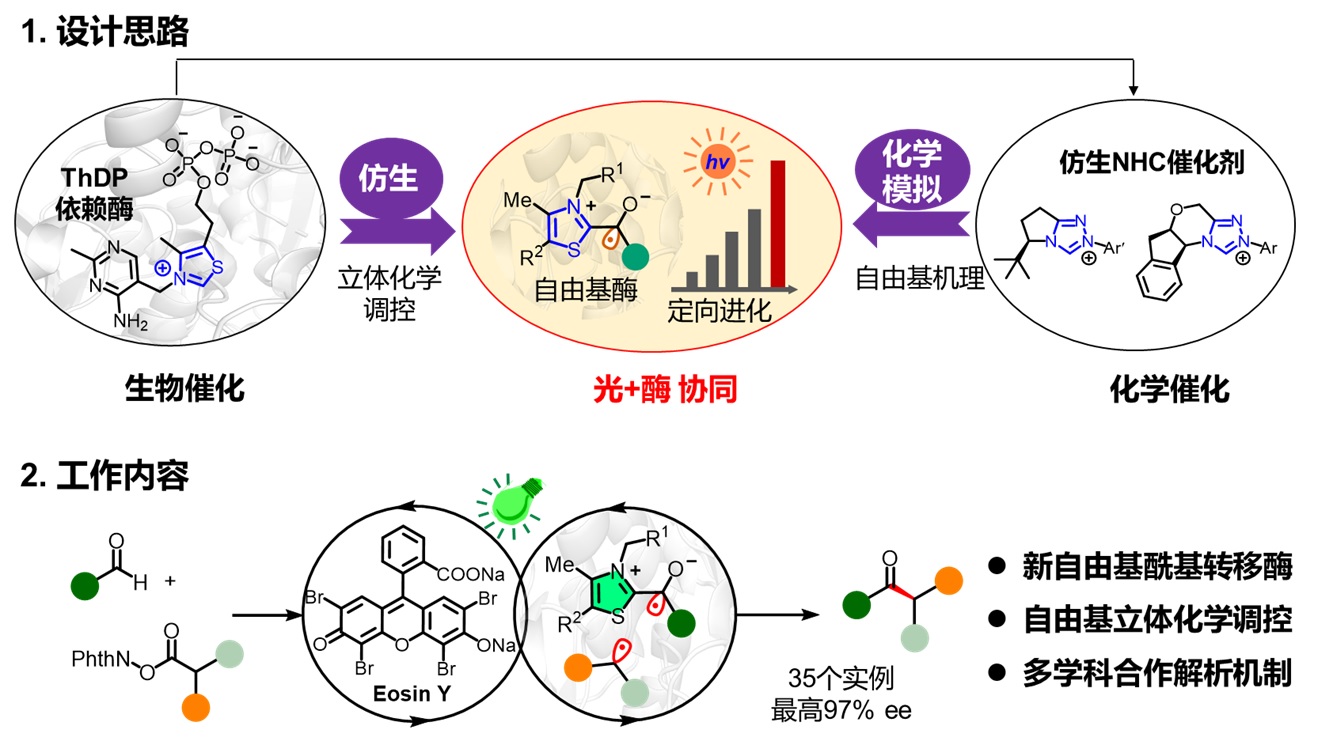
酶催化与光催化结合的光酶催化,融合了可见光化学多样的反应性和酶的高选择性,成为开发新酶功能最前沿的策略。研究团队综合利用仿生和化学模拟的思路(图1),借助可见光激发和定向进化手段,改造焦磷酸硫胺素(ThDP)依赖酶,从而将ThDP依赖的苯甲醛裂解酶“重塑”为自由基酰基转移酶(RAT),实现了一例非天然的高对映选择性的自由基-自由基偶联反应。
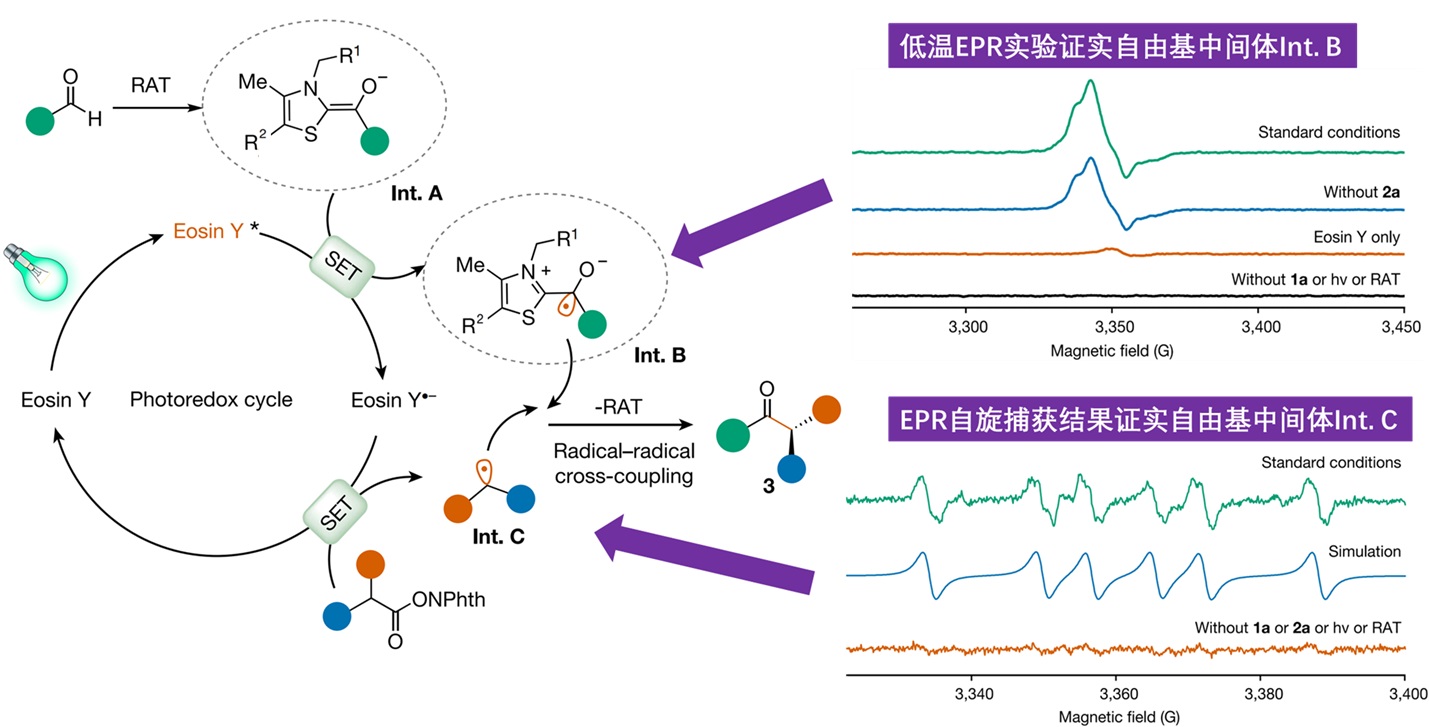
针对该光酶双催化体系,研究团队综合应用了低温电子顺磁共振技术和理论化学计算等方式,对机理开展了详细研究。其中通过低温(80K)下的电子顺磁共振实验,捕获到了由ThDP所衍生的ketyl自由基(Int. B),并且控制实验表明:PfBAL酶、光敏剂Eosin Y、底物1a、光照都是产生该自由基中间体必不可少的关键因素。另一方面,通过EPR自旋捕获(spin trapping)实验在标准反应体系中检测到了特征的六重裂分谱图,证实其为中间体benzylic radical(Int. C)与捕获剂加成后的自由基产物(图2)。电子顺磁共振实验为证实该催化循环中两种关键的自由基中间体(Int. B和Int. C)的存在提供了关键的直接实验证据,揭示了新酶反应性的关键以及高立体化学选择性的来源。
南京大学化学化工学院博士研究生许园园、特任副研究员陈红威和中国科学院合肥物质院强磁场中心、安徽省高场磁共振成像重点实验室于璐副研究员为论文的共同第一作者。南京大学黄小强研究员、梁勇教授和强磁场中心田长麟教授为论文的共同通讯作者。该工作得到了科技部重点研发计划、国家自然科学基金、中国科学院先导B、中国科学院青促会等项目支持。
原文链接:https://doi.org/10.1038/s41586-023-06822-x
图1:融合化学与生物,开发新生物合成体系
图2:机理推测与基于EPR方法的机理探究